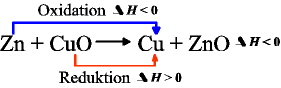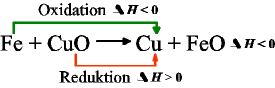 |
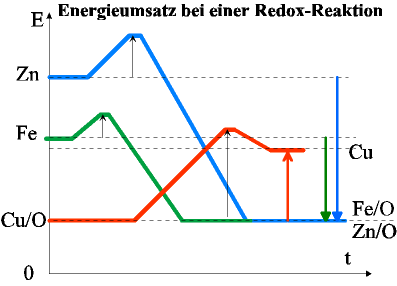
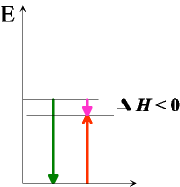
Wir haben es hier mit zwei Reaktionen zu tun, die blaue Zink mit Kupferoxid (rot) und die grüne, Eisen mit Kupferoxid.
Man erkennt, dass die Energieabgabe (der blaue bzw. grüne Pfeil nach unten) größer ist, als die Energieaufnahme bei Kupferoxid(roter Pfeil nach oben).
Eisen und Zink reagieren stark exotherm mit Sauerstoff, daher können sie beide das Kupferoxid, das nicht so viel Energie aufnehmen kann, reduzieren.
|
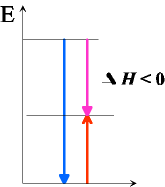 |
Bei dieser Reaktion gibt Zink sehr viel Energie ab (blauer Pfeil nach unten, Kupferoxid nimmt ein wenig Energie wieder auf.
(roter Pfeil nach oben).Als Differenz bleibt aber immer noch der rosa Pfeil mit der Spitze nach unten, also ein exothermer Prozess!
(delta H < 0) |
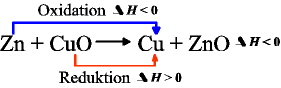 |
 |
Auch hier gibt Eisen (grüner Pfeil) bei der Reaktion Energie ab, aber deutlich weniger als das Zink. Zur Reduktion von Kupferoxid (roter Pfeil) wird Energie benötigt.
Insgesamt wird nur wenig Energie nach aussen abgegeben (rosa Pfeil nach unten, delta H < 0). |
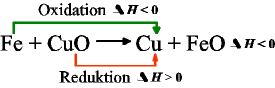 |